pH воды или водородный показатель – является одним из наиболее широко используемых характеристик водных растворов, как в технике так и в биологии. Важность которую имеет водородный показатель можно себе представить, если вспомнить что снижение pH во внутренних средах организма всего на пол единицы приведет к смерти.
Значение pH воды для живого организма
Живые организмы приспособились к определенным условиям существования. И в этих условиях, к которым они приспособлены, они могут поддерживать гомеостаз неопределенно долгое время. В условиях резко отличающихся от тех, к которым приспособлен организм, его способности к поддержанию гомеостаза резко падают. Окружающая среда имеет определенные характеристики, одной из которых является водородный показатель. Чем более близки условия окружающей среды к идеальным для данного вида, тем проще организму поддерживать постоянство внутренней среды. Тем лучше организм себя чувствует, меньше болеет и дольше живет.
Чаще для живых организмов предпочтительно, чтобы водородный показатель окружающей среды был близок к нейтральному значению. Все это приводит к необходимости контроля кислотности окружающих нас растворов и аквариумной воды в том числе. Попробуем найти способ наиболее приемлемый для домашних условий.
Что такое pH?
Водородный показатель – отрицательный логарифм концентрации водородных ионов. pH = — ln[H+] . Понятие водородного показателя введено датским химиком Сёренсеном в 1909 году. Обозначается первыми буквами английских слов potentia hydrogeni(сила водорода) или pondus hydrogenii (вес водорода). Произносится «пэ аш» в русской транскрипции, «пи эйч» в английской.
В чистой воде при температуре 25 градусов по Цельсию концентрация ионов водорода [H+] и гидроксид ионов [OH—] одинаковы и равны 10−7 моль/л.
Что вытекает из уравнения [H+] *[OH—] =10−14 моль²/л² при 25 градусах по Цельсию. Если концентрации обоих видов ионов в воде равны [H+] =[OH—], то раствор имеет нейтральную реакцию. То есть рН=7. Если концентрация водородных ионов[H+] увеличивается, то значение pH уменьшается и становится меньше семи, а кислотность раствора увеличивается, а щелочность соответственно уменьшается.
Если же увеличивается концентрация гидроксид ионов [OH—], то значение pH увеличивается (становится больше 7). Щелочность раствора увеличивается, а кислотность снижается.
Современная шкала pH
На сегодняшний день используется шкала рН поделенная на 14 делений.
0 – минимум (очень кислая среда). 7- нейтральная. 14 – максимум (сильно щелочная среда). Справедливости ради надо сказать, что значения pH могут выходить за пределы принятой на сегодняшний день шкалы и может быть и меньше нуля и больше 14. Но в технике это встречается довольно редко, а в биологии тем более. Так что такое представление одного из параметров окружающей среды всех устраивает.
В биологии и технике на сегодняшний день существует несколько основных способов для определения рН. Рассмотрим каждый из них подробнее.
Основные методы определения pH воды
Определение pH воды с помощью цветовых органических индикаторов.
Многие органические вещества могут изменять свой цвет в зависимости от кислотности. Самый известный подобный «индикатор» это чай. Когда вы бросаете в стакан с крепким коричневым чаем ломтик лимона, чай в стакане становится значительно светлее. При снижении pH, то есть при увеличении кислотности благодаря лимонной кислоте чай меняет свою окраску на более светлую.
Другим не менее известным «индикатором» является сок столовой свеклы. Хозяйки давно знают его способность принимать более насыщенный красный цвет в кислой среде. После того как борщ практически готов и имеет оранжевый цвет добавьте в него немного уксуса и прямо на глазах ваше блюдо окрасится в ярко красный цвет.
Конечно, такие индикаторы в технике и биологии на сегодняшний день не применяются в силу различных причин.
Сейчас наиболее известными индикаторами в химии являются лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и ряд других.
Эти индикаторы могут иметь два цвета в зависимости от кислотности среды. Цвет для каждого из индикаторов может изменяться в диапазоне 1 – 2 единицы рН.
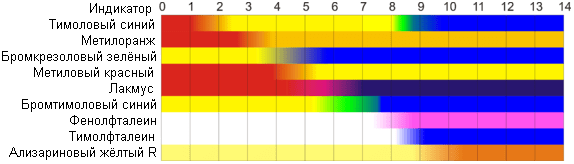
Следовательно, этот метод определения водородного показателя имеет ряд недостатков. Во-первых, определять кислотность можно лишь в определенном небольшом диапазоне значений рН. Этот недостаток иногда обходят, приготовляя универсальный индикатор – смесь нескольких из выше перечисленных индикаторов. Но этот индикатор все же не охватывает всю шкалу активности водорода.
Во вторых использование изменения окраски индикатора для определения активности водородных ионов сильно затруднено, а иногда и невозможно в мутных и цветных средах
Определение pH воды Кислотно основное титрование

С помощью этого метода можно точно определить величину концентрации ионов водорода. Методика в общих чертах заключается в следующем. В определенный объем исследуемого раствора с индикатором по каплям прибавляют раствор с известной концентрацией водородных ионов до изменения окраски раствора. Что свидетельствует о том, что в исследуемый раствор добавлено количество титранта необходимое для полного завершения реакции. Далее зная точную концентрацию титранта и его объем добавленный до изменения окраски можно вычислить концентрацию водородных ионов в испытуемом растворе.
Не смотря на точность метода, он все же нам не совсем подходит для домашнего использования. Во-первых, он требует дополнительного химического оборудования. А мы же не хотим превращать нашу квартиру в химическую лабораторию.
Во-вторых, он требует определенных навыков в приготовлении химических растворов точной концентрации, так же к минусам относится необходимость химических расчетов. То есть метод громоздкий и не оперативный.
И в-третьих проведение анализа так же затруднено в цветных и мутных жидкостях.
Однако при наличии доступа к химической лаборатории это, наверное, единственный метод для первичной калибровки приборов и тест полосок и дальнейшей проверки их показаний.
pH метрия с помощью электронного прибора.

На сегодняшний день, наверное, самый удобный способ определить водородный показатель это электронная pH метрия.
Основана на измерении ЭДС гальванической цепи, в состав которой входит специальный стеклянный электрод. Потенциал этого электрода зависит от концентрации водородных ионов в исследуемом растворе.
pH метры имеют давнюю историю. Особенно стимулировалось развитие подобной измерительной аппаратуры в 1940 – 1950 годах оборонным заказом. Вследствие острой необходимости в подобных приборах для контроля технологических процессов на вредных производствах и в агрессивных средах.
Результатом исследований, которые прошли ряд открытий, много удач и столько же ошибок являются современные компактные приборы с электродной парой, в которой основным электродом является стеклянный. А вспомогательным – хлорсеребряный.
Электронная схема прибора прошла тоже не малый путь от мостовой схемы до современных схем построенных на аналого-цифровых преобразователях и управляемых микропроцессорами.
Всем хорош pH метр. Охватывает весь диапазон концентрации водородных ионов. Имеет точность измерения порядка 0,01. Можно измерять водородный показатель в мутных и цветных средах. Один единственный у них недостаток это цена.
Хотя сейчас в продаже есть рН метры, рассчитанные специально на любителей аквариумистов и огородников. Эти приборы обладают достаточной точностью при сравнительно невысокой цене.
В заключение этой небольшой обзорной статьи о большой и обширной теме хочется сделать вывод, что на сегодняшний день для определения pH в домашних условиях могут быть рекомендованы либо тест полоски для определения pH. Либо рН метры – электронные приборы со стеклянными электродами и процессорным управлением.
Тест полоски и рН метры требуют отдельных обзорных статей. К тому же существует возможность самостоятельного изготовления тест полосок для определения pH. И существуют конструкции самодельных pH метров.






